-
Нейроны меняют собственную днк
06.12.2013
 Наука и жизнь
Наука и жизнь -
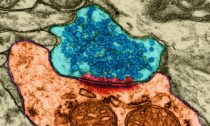
Дабы мозг трудился прекрасно, его клетки должны мочь налаживать сообщение со собственными соседями. Оказалось, что действенная регуляция межнейронных контактов зависит от микроповреждений в собственной ДНК нейронов.
Стабильность ДНК – залог продолжительной и радостной судьбе, исходя из этого всякие мутации клетка старается ликвидировать посредством особых молекулярных автомобилей. Само собой разумеется, тут возможно отыскать в памяти про явление кроссинговера, что происходит, к примеру, на протяжении созревания половых клеток (и по большому счету у делящихся клеток) – при кроссинговере происходит масштабный обмен ДНК-фрагментами между гомологичными хромосомами.
Но данный процесс находится под тщательным контролем, и привязан он всё-таки к клеточному делению. Что же до остальных случаев нестабильности генома, то они появляются или по внешним обстоятельствам (наподобие мутагенного излучения), или из-за не через чур правильной работы молекулярных автомобилей, занимающихся ремонтом и удвоением ДНК. Обычная, здоровая клетка старается как возможно тщательнее смотреть за трансформациями в хромосомах и по возможности восстанавливать всё, как было.
Синаптический контакт между нейронными отростками, синим выделены пузырьки–везикулы с нейромедиатором. (Фото Dennis Kunkel Microscopy, Inc. / Visuals Unlimited / Corbis.) Нейроны гиппокампа мыши: слева – обычные клетки с громадным числом рецепторного белка GluR1 (окрашен оранжево-жёлтым), справа – нейроны с повышенной активностью гена Tet3, подавляющего синтез GluR1. (Фото Huimei Yu / Johns Hopkins Medicine.)‹ ›
Тем необычнее выглядят результаты исследовательской группы Хунцзюнь Суна (Hongjun Song) из Университета Джонса Хопкинса . Он и его сотрудники поняли, что простые, зрелые нейроны мозга всегда вносят исправления в собственную ДНК, пользуясь эпигенетическими метками. Как мы знаем, дабы поменять активность того либо иного гена, клетке не требуется вмешиваться в последовательность нуклеотидов, достаточно снабдить ген особыми маркерами, каковые сделают его менее привлекательным для белков, синтезирующих РНК. Такими маркерами выступают метильные группы, каковые пришиваются к азотистому основанию цитозину, одному из четырёх «букв» генетического кода. (В скобках увидим на всякий случай, что метильные метки и по большому счету эпигенетическая регуляция далеко не единственный метод управления активностью генов.)
Прометилировать ДНК легко, но не редкость, что метку необходимо с цитозина снять. Это сделать уже не так легко, в этот самый момент запускается целая цепь реакций, причём по ходу дела меченая «буква» вырезается и на её место вставляется простой, неметилированный цитозин. Другими словами в одной из цепей ДНК образуется дыра, которая представляет собой сильный элемент нестабильности – так как ко мне может по неточности попасть какая-то вторая «буква», и у нас окажется настоящая мутация.
Однако, процессы метилирования и деметилирования ДНК идут в клетках млекопитающих достаточно деятельно, причём кроме того в таком «ласковом» органе, как мозг, что по большому счету по максимуму защищён от непредсказуемой окружающей среды и от остального тела.
В собственной статье в Nature Neuroscience авторы работы пишут, что в нейронах мозга мыши деметилирующая активность была чётко связана с синаптической пластичностью клеток. Под синаптической пластичностью знают свойство нейрона регулировать силу межнейронного соединения с соседями – благодаря ей импульс в цепочке может слабеть либо усиливаться.
На молекулярном уровне это возможно заметить по тому, как изменяется количество нейромедиаторов, передающих сигнал от одного нейрона к второму, и как изменяется количество нейромедиаторных рецепторов у «принимающей стороны» – чем в более широком диапазоне происходят трансформации, тем большей пластичностью владеет нейрон. Так вот, в то время, когда в клетках мозга отключали ген Tet3, что подавляет деметилирование, синаптическая пластичность увеличивалась; и напротив, в то время, когда активность Tet3 стимулировали, пластичность понижалась.
Предстоящие опыты продемонстрировали, что ген Tet3 воздействует на уровень синаптического белка GluR1, что именно является рецептором для нейромедиаторов. В случае если нейроны начинали реагировать на самый ничтожный раздражитель, активность Tet3 возрастала, и как следствие, понижался уровень рецептора GluR1 – другими словами клетки прекратили реагировать на мельчайшие трансформации в импульсах, синапсы возвращались к стандартному режиму работы.
Но могло быть и обратное: в случае если активность синапсов очень сильно уменьшалась, у Tet3 она уменьшалась также, так что уровень GluR1 увеличивался – что, со своей стороны, отражалось на работе синапсов. Активность же гена, несущего ответственность за деметилирование, возможно было заметить по состоянию ДНК, по тому, как довольно часто в ней происходило вырезание нуклеотида.
Синаптическая пластичность связана со свойством к обучению – считается, что чем она больше, тем лучше для мозга. Но у неё, разумеется, должны быть какие-то регуляторы, одним из которых нежданно был ген Tet3, реагирующий на трансформации активности межнейронных контактов. Само собой разумеется, появляется вопрос, как как раз такая «микрохирургия» ДНК, другими словами постоянное вырезание букв из последовательности нуклеотидов, воздействует на свойство синапсов реагировать на различные сигналы.
Быть может, что бреши в ДНК-цепочках приходятся именно на те гены, что конкретно воздействуют на силу и чувствительность синапсов, но что именно там происходит, возможно будет определить только из предстоящих изучений.
Создатель: Кирилл Стасевич
Источник: nkj.ru
Случайные записи:
Susan Solomon: The promise of research with stem cells
Похожие статьи, которые вам понравятся:
-
Почему нейроны не похожи друг на друга
Нейроны людской мозга поразили своим разнообразием. Пара лет назад стало известно, что геномы отдельных нейронов значительно отличаются между собой, и…
-
Нейроны учат новое, не забывая старое
Столкнувшись с трансформациями в окружающем мире, отдельные нейроны перенастраивают собственную активность, но наряду с этим они не забывают и те…
-
Где у нейронов прячется память
Трудящийся нейрон не обязательно запоминает все данные, которая проходит через него. Дабы это случилось, должны совпасть между собой активности различных…
-
Гибкие электроды помогут следить за нейронами долгие годы
Исследователи Гарвардского университета внесли предложение биосовместимую совокупность эластичных микроэлектродов для долгосрочного мониторинга…
-



