-
Как остановить болезнь альцгеймера
05.11.2013
 Наука и жизнь
Наука и жизнь -
Заболевание Альцгеймера страшна не столько протеиновыми отложениями в мозге, сколько маленькими молекулярными комплексами, каковые именно и отравляют нейроны. В случае если не допустить появление таких комплексов, то возможно остановить и саму заболевание.
Заболевание Альцгеймера относится, увы, к летальным нейродегенеративным болезням, каковые обусловлены любопытной, но очень неприятной свойством некоторых белков покупать патогенную пространственную конформацию. Пространственная конформация – это то, как свёрнута аминокислотная цепь протеиновой молекулы. От трёхмерной укладки белка зависят его функции и свойства, сотрудничества с другими протеиновыми (и не только) молекулами.
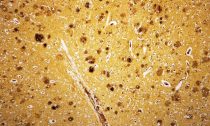
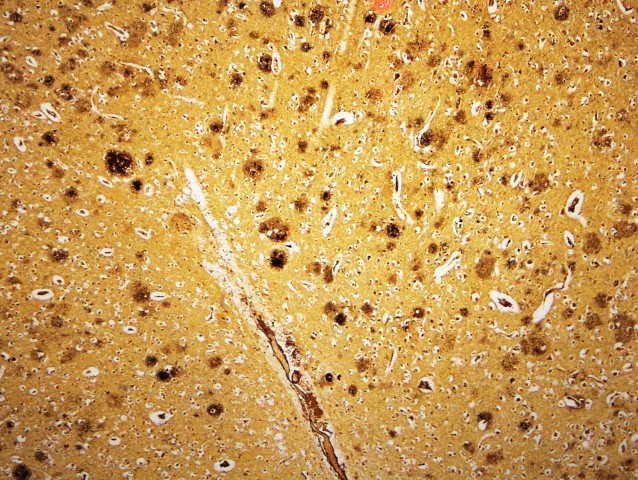
Микроэлектронная фотография амилоидной фибриллы с прикреплёнными к ней шаперонами (тёмные точки). (Фото Samuel Cohen / University of Cambridge.) Ткань мозга с альцгеймерическими бляшками. (Фото UCSF / Corbis.)‹ ›
При нейродегенеративных заболеваниях белки в нейронах покупают такую конформацию, в результате которой они слипаются между собой и образуют нерастворимые комплексы, разрастающиеся позже в бляшки, фибриллы и т.
 д. Довольно продолжительное время пологали, что клетки гибнут как раз из-за накапливающихся протеиновых отложений. Но позже оказалось, что, по крайней мере, при синдроме Альцгеймера, молекулярные события развиваются в две стадии.
д. Довольно продолжительное время пологали, что клетки гибнут как раз из-за накапливающихся протеиновых отложений. Но позже оказалось, что, по крайней мере, при синдроме Альцгеймера, молекулярные события развиваются в две стадии.Слипаясь, патогенный белок бета-амилоид образует нитевидные комплексы – фибриллы. Но около всё равняется остаётся большое количество амилоидных молекул, ещё не успевших провзаимодействовать между собой. И вот для них оказавшаяся нить является платформой для сборки: свободные молекулы взаимодействуют с ней, меняют конформацию на патогенную, и формируют маленькие олигомерные комплексы-кластеры, каковые смогут существовать в плавающем, растворимом состоянии.
В соответствии с последним данным, как раз такие маленькие кластеры владеют высокой токсичностью, и как раз они – а не выпавшие в бляшки и осадок нити – именно и вредят нейронам.
Плавающие олигомеры в итоге дают начало новым нерастворимым фибриллам, на которых опять начинается стадия олигомерных кластеров, названную стадии вторичной нуклеации. Разумеется, что с каждой новой нитью количество токсичных кластеров будет расти во большое количество, неоднократно – данный цикл возможно уподобить цепной реакции. И в случае если раньше искали лекарства, каковые предотвращали бы появление пресловутых бляшек и фибрилл, то сейчас всё чаще показывают, что необходимо отыскать средство, подавляющее вторую стадию – так мы скорее сможем воспрепятствовать смерти нейронов и задержать развитие заболевания.
И тут большого успеха удалось добиться интернациональной группе исследователей из Кембриджского университета, Каролинского университета, университетов Лунда и Уппсалы. В статье в Nature StructuralMolecular Biology Сэмюэл Коэн (Samuel Cohen) и его сотрудники обрисовывают воздействие человеческого шаперона Brichos. Шаперонами именуют белки, каковые оказывают помощь вторым белкам в буквальном смысле «держать форму»: в случае если какой-то белок внезапно приобрёл неправильную, нефункциональную, вредную пространственную конформацию, то шаперон окажет помощь её исправить, а заодно и предотвратит агрегацию протеиновых молекул в ненужные комки.
Но в этом случае шаперон Brichos действует в противном случае. Он садится на готовую альцгеймерическую фибриллу именно в тех местах, где происходит инициация новых кластеров из вольно плавающих молекул бета-амилоида. В следствии цикл цепной реакции размыкается – любая патогенная молекула вынуждена вырабатывать токсичный кластер без помощи уже готовой фибриллы, а в этом случае процесс идёт намного, намного медленнее.
Шаперонный белок протестировали на мышах, у которых в мозгах был запущен альцгеймероподобный процесс. Оказалось, что, не смотря на то, что новые фибриллы и оказались, нейроны оставались устойчивыми и не гибли, как если бы токсичный эффект от заболевания исчезал. Разумеется, всё происходило так, как и планировалось: из-за белка-ингибитора очень сильно падала концентрация олигомерных ядовитых комплексов.
Сейчас осталось лишь осознать, как применять шаперон Brichos в практических целях – раз уж он уже имеется у человека, запрещено ли как-то стимулировать его активность при нейродегенеративных процессах? Но основной итог работы, по словам её авторов, кроме того не в том, что им удалось продемонстрировать нужное воздействие этого белка, а в том, что они создали способ, что разрешит целенаправленно искать молекулы с этими же особенностями.
Исследователи смогли выстроить модель, обрисовывающую молекулярные процессы и в том и другом случае: и тогда, в то время, когда заболевание начинается как в большинстве случаев, и тогда, в то время, когда стадия вторичной нуклеации отключена. Так что в будущем новые вещества возможно оценивать по тому, как они вписываются в созданную модель, переключают ли заболевание из страшного состояния в надёжное.
Создатель: Кирилл Стасевич
Источник: nkj.ru
Случайные записи:
- Томограф чувствует ложь лучше полиграфа
- Гробница эпохи александра великого: новые находки и старые вопросы
В лечении болезни Альцгеймера – прорыв (новости)
Похожие статьи, которые вам понравятся:
-
Как свет помогает мозгу бороться с болезнью альцгеймера
Световые импульсы определённой частоты уменьшают уровень патогенных белков, запускающих нейродегенеративные процессы. Заболевание Альцгеймера, как и…
-
Ученым удалось восстановить интеллект 10 пациентов с болезнью альцгеймера
Американским ученым удалось обратить понижение интеллекта у10 больных с ранними стадиями заболевания Альцгеймера либо предшествующими им состояниями….
-
Лекарственные антитела тормозят болезнь альцгеймера
Человеческие антитела против патогенного белка, вызывающего заболевание Альцгеймера, уничтожают страшные протеиновые отложения в мозге больных….
-
Тест, способный предсказать болезнь альцгеймера
В первый раз создан тест, благодаря которому возможно угадать происхождение заболевания Альцгеймера у человека перед тем, как у него начнут проявляться…




