-
Антисмысловая терапия «болезни хокинга» прошла доклинические тесты
13.05.2011
 Hi-tech
Hi-tech -
Группа исследователей из америки заявила об успешном проведении доклинических изучений новой генной терапии бокового амиотрофического склероза (БАС) и спиноцеребеллярной атаксии.
Боковой амиотрофический склероз и спиноцеребеллярная атаксия — нейродегенеративные заболевания, каковые объединяет схожая клиническая картина. И в том и другом случае разрушение нейронов ведет к нарушению двигательных функций, наряду с этим БАС кроме этого повышает риск паралича. На данный момент универсальных способов лечения этих патологий не существует.
Как мы знаем, что спиноцеребеллярная атаксия 2 типа связана с мутациями в гене ATXN2 (атаксин-2). Дефектный ген накапливает повторы триплета, что кодирует глутамин, что нарушает функции одноименного белка. На клеточном уровне это проявляется в понижении активности клеток Пуркинье, участвующих в регуляции моторики.
Новая генная терапия основана на неестественной супрессии ATXN2 в мозжечке — в соответствии с догадке, это должно ослабить симптомы заболевания. Дабы проверить предположение, авторы вывели линию мышей с мутантным геном. После этого в их мозжечок вводили антисмысловые олигонуклеотиды — маленькие цепочки ДНК, комплементарные атаксину. На протяжении отбора разных олигонуклеотидов ученые выяснили самый оптимальный по показателю подавления.
Подавление экспрессии осуществлялось за счет связывания молекул с матричной РНК (мРНК) ATXN2 и предотвращения синтеза белка. В соответствии с наблюдениям, ДНК, введенная в мозжечок, достигала клеток Пуркинье и уменьшала выработку дефектного атаксина. Наряду с этим нейроны животных вернули свойство к активации, а их моторика улучшилась.
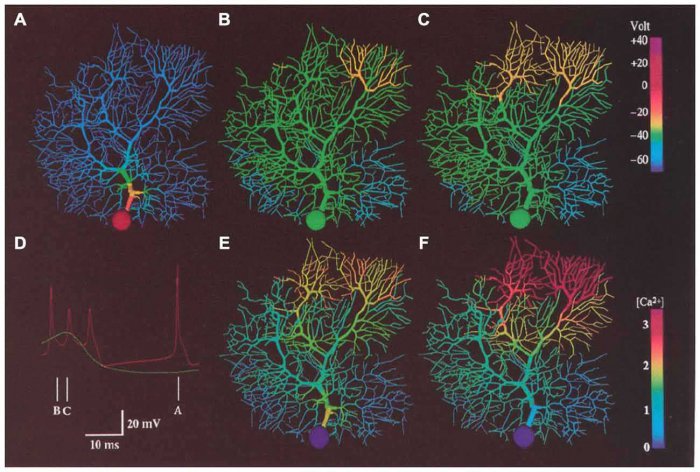
Уменьшение стрессовых гранул, содержащих TDP-43, по окончании введения олигонуклеотида / ©Lindsay A. Becker et al., Nature, 2017
В 2012 году несколько американских ученых кроме этого продемонстрировала наличие связи между ATXN2 и БАС. В нейронах больных с боковым амиотрофическом склерозом довольно часто отмечается агрегация TDP-43 — ядерного белка, регулирующего транскрипцию многих генов. Исследователи поняли, что понижение этих белков взаимосвязано, но механизм таковой корреляции остается неясным.
Предполагается, что обстоятельством может служить свойство атаксина-2 инициировать формирование стрессовых гранул, каковые включают в себя РНК и связанные с ней белки, а также TDP-43. В новой работе авторы смоделировали у мышей БАС методом синтеза в их организме громадного количества человеческого TDP-43, по окончании чего ввели олигонуклеотид, испытанный на атаксии.
В соответствии с итогам, процедура повысила длительность судьбы пострадавших особей на треть, а их двигательные функции частично восстановились. На сегодня антисмысловые олигонуклеотиды одобрены властями США для лечения последовательности нейродегенеративных болезней, к примеру спинальной мышечной атрофии (СМА). Предположительно, по окончании успешного завершения доклинических изучений новая терапия атаксии и БАС может вступить в первую фазу опробований на человеке.
Подробности работ опубликованы (1, 2) в издании Nature.
Боковой амиотрофический склероз стал широко известен благодаря истории английского физика Стивена Хокинга. Об необычной судьбе этого ученого просматривайте в отечественном материале.
Случайные записи:
- Монокристаллы органических полупроводников
- Графеновые микроботы могут очистить воду от токсичных соединений и тяжелых металлов
УДИВИТЕЛЬНАЯ ЖИЗНЬ СТИВЕНА ХОКИНГА: ДО И ПОСЛЕ БОЛЕЗНИ
Похожие статьи, которые вам понравятся:
-
45-Летняя женщина утверждает, что прошла первую в мире генную терапию против старения
Элизабет Пэрриш [Elizabeth Parrish], жительница Сиэтла, 45-и лет, директор стартапа со специализацией на биотехнологиях BioViva говорит, что удачно…
-
Новый генетический тест поможет в терапии рака легкого
Москва, 20 января 2015 года – Мин образования России в рамках ФЦП «разработки и Исследования по приоритетным направлениям развития…
-
Тест, способный предсказать болезнь альцгеймера
В первый раз создан тест, благодаря которому возможно угадать происхождение заболевания Альцгеймера у человека перед тем, как у него начнут проявляться…
-
Ученые доказали связь между болезнью альцгеймера и диабетом
В соответствии с итогам двух особых изучений, о которых было сравнительно не так давно размещено в американском научном ежемесячнике Джорнал оф Клиникал…