-
Мембранные белки поймали в нанодиски
09.03.2016
 Наука и жизнь
Наука и жизнь -

Заменив «мыло» на липидные нанодиски, биофизики из МФТИ смогли разглядеть мембранный белок в природном состоянии.
Каждая протеиновая молекула – это цепочка из аминокислот, каковые выстроены в определенном порядке. Их порядок для одного белка один, для другого – второй, и т. д. Но ни один белок не существует в виде ровной аминокислотной «веревки». Аминокислоты, подчиняясь физико-химическим силам, взаимодействуют между собой, притягиваются и отталкиваются, и в следствии протеиновая молекула сворачивается в сложную трехмерную структуру.
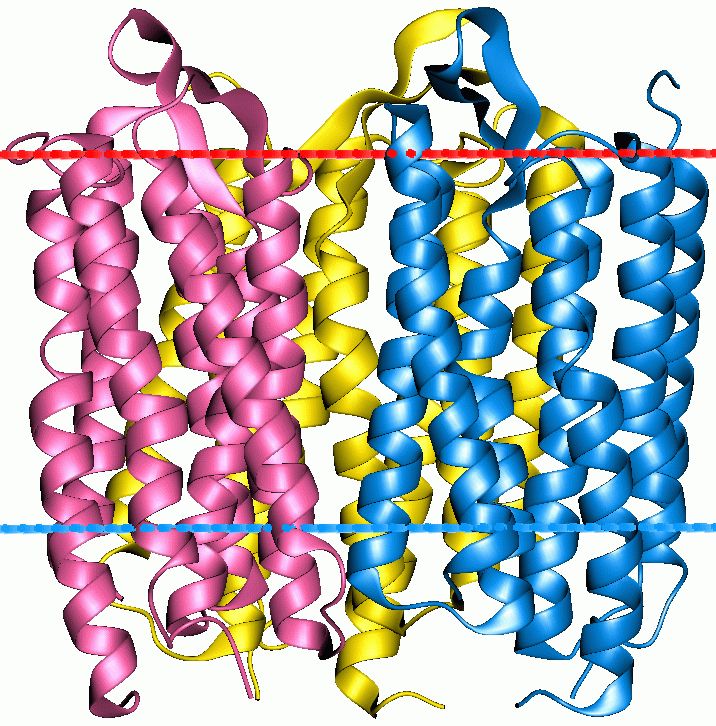
Структура белка бактериородопсина: та часть белка, которая находится между синей и красной линиями, загружена в мембрану, то, что выше красной линии, выглядывает из клетки во окружающую среду. (Иллюстрация: Wikipedia.) 1. Мембранные белки, живущие в оболочке клетки. 2. Те же белки в нанодисках, стянутые протеиновым «поясом». 3. Протеиновый кристалл.
4. Молекулярная структура, полученная способом рентгеновской дифракции. (Иллюстрация: МФТИ.) Молекула белка в среде для кристаллизации теряет нанодиск около себя и стягивающий ее протеиновый «пояс» и получает возможность превратиться в кристалл. (Иллюстрация: M.
 Nikolaev et al., Cryst. Growth Des., 2017, 17 (3), pp 945–948.)‹ ›
Nikolaev et al., Cryst. Growth Des., 2017, 17 (3), pp 945–948.)‹ ›Как раз трехмерная структура определяет функции белка – будет ли он расщеплять сахара, либо жирные кислоты, либо будет связывать какие-то металлы, либо будет взаимодействовать с другими белками. Не редкость, что функций у белка пара, но в любом случае он может делать собственную работу лишь благодаря трехмерной структуре. И дабы выяснить, как он трудится, мы должны эту самую структуру знать во всех подробностях.
Возможно, с одной стороны, постараться угадать пространственную структуру белка по последовательности аминокислот, которую выяснить достаточно легко. Но предсказательные способы, не смотря на то, что среди них имеется достаточно действенные, довольно часто промахиваются мимо цели. Иначе, возможно разглядеть сам свернутый белок.
Но для этого его необходимо перевоплотить в кристалл, и после этого, посредством рентгеноструктурного анализа и особых математических способов, мы осознаем, как он выглядит. И тут, уже в случае если мы что-то заметили, то заметили.
Но неприятность в том, как закристаллизовать тот либо другой белок. В случае если речь заходит о белках, каковые трудятся в водном растворе, наподобие какого-нибудь фермента либо глобина, то с ними все довольно легко: в кристалле они сохраняют в основном ту же пространственную структуру, что и в растворе (тут имеется кое-какие тонкости, которые связаны с тем, что молекулы белков, по большому счету говоря, все время как бы «дышат» – их пространственная структура мерцает, но в целом подвижность тех или других частей молекулы возможно выяснить по кристаллической структуре). Такие растворимые белки, кстати говоря, как правило напоминают весьма рельефную «картошку», лишь глобиновая «картошка» выглядит в противном случае, чем «картошка» какого-нибудь фермента-протеазы.
Но существует второй класс очень занимательных белков, для которых взять кристалл не так-то легко. Речь заходит о мембранных белках, а сложность с ними в том, что кое-какие части их молекул загружены в липидную мембрану, а кое-какие торчат из мембраны в водный раствор. В случае если вытащить липидную часть в воду, ее пространственная структура изменится, и это уже будет не совсем тот белок, что делает собственную работу в мембране.
А среди таких белков возможно назвать рецепторы, благодаря которым клетка определит, что делается снаружи, и сигнальные белки, каковые довольно часто связаны с рецепторными и каковые передают сигнал из окружающей среды вовнутрь, и транспортные белки, переправляющие различные вещества в клетку и из нее. В случае если сказать об их практическом значении, то 70 процентов существующих в продаже лекарств действуют именно на мембранные белки. Словом, весьма и довольно много в нашей жизни зависит от мембранных белков, а изучать их весьма и весьма тяжело: сейчас известны структуры всего 3 процентов мембранных белков из семи тысяч.
Один из способов сохранить подлинную (либо, в случае если сказать более корректно, нативную, природную) структуру мембранного белка – создать для него такую среду, в которой он ощущал бы себя, как в родной липидной мембране. Для этого применяют особенные нанодиски, идею которых внес предложение в 2002 году Стивен Слигар из Иллинойского университета в Урбана-Шампейне: мембранный белок встроен в нанодиск, имитирующий участок клеточной мембраны, а потому, что таковой диск не через чур устойчив, его еще стягивают запасным протеиновым «поясом». (Подобные «поясные» белки употребляются в отечественном организме, дабы транспортировать «охапки» липидных холестерина и молекул по кровеносным сосудам.)
Трудясь с мембранным белком, заключенным в нанодиск, возможно изучать, как он реагирует на разные вещества. Это несложнее, чем трудиться с целой клеткой, по поверхности которой плавает масса разнородных мембранных белков (не говоря уже о том случае, в то время, когда мы имеем дело с белками клеточных мембранных органов – митохондрий, эндоплазматической сети и т. д.).
Но в случае если нам нужен кристалл, то все равно перед нами стоит задача извлечь белок наружу из нанодиска. В большинстве случаев тут применяют детергент, что, действуя, как простое мыло, растворяет нанодиск, но в один момент стабилизирует сам белок. Но белок все равно выясняется в другом окружении, все-таки детергент – это не липидные молекулы мембраны и не похожий на нее нанодиск; он как-то видоизменяется, приспосабливаясь к детергенту, так что все равно появляется неприятность ненатуральной структуры.
Исследователи из лаборатории перспективных изучений мембранных белков Столичного физтех университета вместе с сотрудниками из Исследовательского центра Юлих и Университета структурной биологии Гренобля нашли метод решить проблему. В собственной статье, опубликованной ACS Crystal GrowthDesign, они пишут, как возможно взять кристаллы мембранного белка, не погружая его в чуждое окружение. Кристаллизация постоянно происходит в некоей среде, и от того, из чего эта среда состоит, зависит и уровень качества кристалла, да и то, окажется ли он по большому счету.
В большинстве случаев, как мы сообщили выше, белки кристаллизуют из водного раствора, в котором плавают разнообразные вещества, помогающие протеиновым молекулам организовать кристалл. Но в новом способе белки кристаллизовались в липидной среде. Такая среда, во-первых, растворяла нанодиски около протеиновых молекул, во-вторых, не портила им пространственную структуру – белки соединялись между собой в кристалл как раз в таком виде, в каком они делают собственную работу, сидя в клеточной мембране.
Исследователи удостоверились в надежности собственный способ на бактериородопсине (фоточувствительном мембранном белке), структура которого известна – и оказалось, что структурный «портрет», полученный посредством нового метода кристаллизации, всецело соответствует тому, что мы знали о бактериородопсине раньше. Сама статья была журнальной cover story (т. е. редакция сочла ее лучшей среди всех материалов месяца и поместила иллюстрацию из нее на обложку номера), а нас, быть может, скоро ожидает целый поток новых сведений о разнообразных мембранных белков, функции и чью структуру удалось расшифровать именно поэтому новому методу кристаллизации.
По данным пресс-службы МФТИ
Создатель: Кирилл Стасевич
Источник: жизнь и Наука (nkj.ru)
Случайные записи:
Георг Бюлдт. Мембранные белки и методы их кристаллизации
Похожие статьи, которые вам понравятся:
-
Белки динозавров сохранились до наших дней
От древних ящеров, по-видимому, сохранились не только кости, но и какие-то остатки мягких тканей. Считается, что от динозавров до нас дошли кости и лишь…
-
С чего начинается синтез белка
Ученые из Москвы уточнили картину молекулярных сигналов на начальных этапах протеинового синтеза. Мы, как мы знаем, приблизительно на 65 процентов…
-
На слабые места раковой опухоли могут указать белки-мутанты
Русские ученые создали компьютерную программу, находящую «неправильные» протеиновые структуры в живых клетках, способные привести к формированию рака….
-
Ученые определили, каким образом перемещаются белки-биомоторы в клетке
Ученые из Массачусетского Технологического Университета (MIT) выяснили, как происходит передвижение в клетке молекул белка-мотора – транспортного белка…
-



