-
Нобелевская премия по химии – от присуждения до награждения
22.03.2011
 Наука и жизнь
Наука и жизнь -
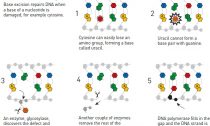
За время, прошедшее с момента объявления нынешних лауреатов Нобелевской премии по химии, биологи успели отыскать новый ДНК-репарирующий фермент, выяснить, как белки ищут неправильные пары нуклеотидов в ДНК, и заметить, как двигается повреждённая ДНК в клетках человека.
Шестого октября мы определили о том, кто в этом году стал лауреатом Нобелевской премии по химии, и поспешили сказать об этом отечественным читателям. Отметим, что премию присудили за исследования репарации ДНК.
Эксцизионная репарация оснований – из ДНК точечно вырезается одна лишь сломанная генетическая «буква». Нобелевскую премию за расшифровку механизма таковой репарации взял Томас Линдаль. (Иллюстрация Нобелевского комитета.) Эксцизионная репарация нуклеотидов, «по Санджару» – из ДНК вырезается целый кусок с повреждённой «буквой». (Иллюстрация Нобелевского комитета.) Репарация ошибочно спаренных нуклеотидов включается при неточностях ДНК-копирующей автомобили, механизм которой был расшифрован Пол Модричем – особые белки выявляют фрагмент с неправильно спаренными нуклеотидами и удаляют его, дабы на его месте появилас Схема строения нуклеотида – трёхчастной молекулы, в состав которой смогут входить различные азотистыми основания, выступающие генетическими «буквами». (Иллюстрация Wikipedia.) Новая гликозилаза (слева), удаляющая модифицированные основания в механизме эксцизионной репарации оснований, не выворачивает их из двойной цепи наружу, как другие гликозилазы (справа), а оставляет его в ДНК-спирали. (Иллюстрация Brandt Eichman / Van От 80 до 90 процентов случаев онкологических болезней связаны с неполадками в ДНК-репарирующих совокупностях. (На фото – клетка рака предстательной железы.) (Фото Visuals Unlimited / Corbis.)‹ ›
В отечественной молекуле наследственности часто случаются недостатки, каковые смогут самым неприятным образом сказаться на здоровье: ДНК может одной либо сходу двумя цепочками, и тогда её легко необходимо сшить обратно, но бывают и более хитроумные повреждения, которые связаны с модификацией букв генетического кода – нуклеотидов, либо же с заменой верных нуклеотидов на неправильные, искажающие суть записанной в ДНК информации. Вот для исправления таких неподобающих замен и модификаций существуют особые совокупности ферментов, и как раз за расшифровку того, как они трудятся, Томас Линдаль, Азиз Санджар и Пол Модрич возьмут 10 декабря собственную нобелевскую приз.
Два месяца с момента объявления лауреатов и до церемонии награждения – с одной стороны, срок маленькой, но лишь если не знать, что нового мы определили за это время про репарацию ДНК. А определили мы много. К примеру, что людская ДНК в районе двуцепочечных разрывов начинает деятельно дёргаться, извиваться, в общем, у неё заметно возрастает подвижность, как словно бы молекула намерено размахивает неожиданно появившимися финишами.
До недавнего времени такую «танцующую ДНК» замечали в различных вторых клетках, и вот наконец то же самое заметили и в человеческих.
Более того, команда из Рокфеллеровского университета, опубликовавшая собственное открытие в Cell, заодно выяснила и те внутриклеточные структуры, каковые увеличивают подвижность ДНК – ими были протеиновые комплексы оболочки ядра и соединённые с ними микротрубочки цитоплазмы. (Микротрубочками именуют долгие палочкообразные структуры, сложенные из множества протеиновых молекул и играющие роль клеточного скелета.) Другими словами ДНК, у которой произошли разрывы в обеих цепях, начинает мельтешить под действием сложного протеинового аппарата, причём это нужно чтобы ремонт прошёл удачно – считается, что в случае если ДНК в месте разрыва будет деятельно двигаться, то репарирующим ферментам будет несложнее отыскать и соединить порванные финиши.
Что до самого механизма зашивания разрывов, то биологи уточняют . К примеру, в статье в Nature Cell Biology исследователи из Университета Альберты обрисовывают поведение белка RNF138, чья задача – снять второй белок, Ku, с появившихся финишей ДНК. Ku помогает им чем-то наподобие заглушки, но в его присутствии ликвидировать разрыв запрещено, исходя из этого и нужен RNF138, о котором до тех пор пока что известно не через чур много.
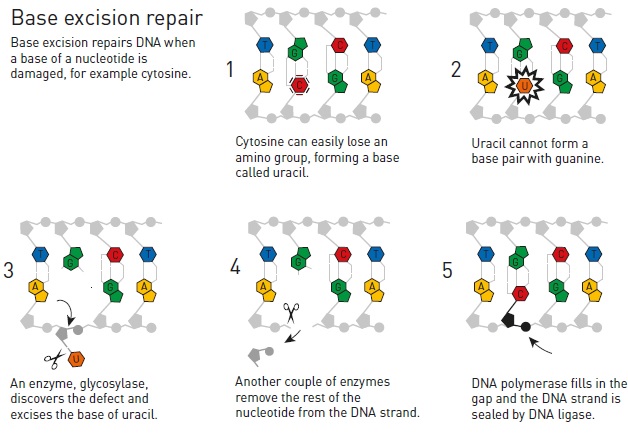
В случае если же говорить о фактически «нобелевских» механизмах репарации ДНК, то тут стоит отыскать в памяти работу биологов из Университета Вандербильта, каковые нашли ещё один белок, участвующий в так называемой эксцизионной репарации путём удаления повреждённых оснований. В то время, когда в ДНК появляется модифицированный нуклеотид, в дело вступают ферменты гликозилазы, каковые отщепляют от нуклеотида повреждённое азотистое основание (напомним на всякий случай, что нуклеотид – это трёхчастная молекула, складывающаяся из остатка фосфорной кислоты, сахара дезоксирибозы и одного из четырёх азотистых оснований; в состав ДНК входят 4 основания, аденин, тимин, цитозин и гуанин, и как раз они и имеется те самые 4 буквы генетического кода).
Механизм эксцизионной репарации оснований ликвидирует целый класс повреждений, и потому гликозилаз (первые из которых обрисовал сегодняшний лауреат Томас Линдаль) существует не одна и не две. Но фермент, что обрисован в Nature, отличается от всех остальных собственных «сотрудников». В большинстве случаев гликозилазы, отыскав повреждённое основание, отрывают его от его партнёра в второй цепи и выкручивают его из двойной спирали наружу, и вот такое торчащее наружу основание химически отщепляется от ДНК.
Новая гликозилаза, названная AlkD, ликвидирует алкилированные основания (другими словами такие, к каким присоединилась углеводородная химическая несколько), но она не поворачивает модифицированное основание наружу (см. рисунок), и сам повреждённый участок распознаёт не напрямую, а по косвенным показателям, и имеет дело с более объёмными модификациями, нежели другие родственные ферменты.
Чтобы исправить любое повреждение в ДНК, необходимо его сперва отыскать. А это задача непростая, учитывая миллиарды и миллионы «букв», из которых состоят геномы живых существ. Разумеется, у белков, занимающихся ремонтом ДНК, должны быть какие-то особенные стратегии поиска – к примеру, репарирующая совокупность может с большей тщательностью смотреть за тем участком генома, где возможность мутаций самый высока.
Несложнее всего реализовать такую стратегию ферментам мисмэтч-репарации, механизмом которой занимался Пол Модрич.
Мисмэтч-репарация исправляет неточности, каковые оставляет по окончании себя аппарат репликации, другими словами удвоения ДНК. Как мы знаем, генетические «буквы»-основания находятся приятель наоборот приятеля в двух цепях ДНК отнюдь не просто так, а в соответствии с правилу комплементарности: аденин стоит наоборот тимина, гуанин наоборот цитозина.
При удвоении ДНК цепи ветхой молекулы разделяются, и на каждой из них синтезируется новая – дочерняя – цепь, так дабы её нуклеотиды были комплементарны нуклеотидам ветхой, материнской цепи. Но не редкость, что ферменты, синтезирующие новые цепи, ошибаются, и ставят в новую цепь совсем не ту «букву», которая в том месте нужна – случается mismatch, либо несовпадение. Так происходит относительно редко – один раз на 30-60 млн оснований – но мутация имеется мутация, и её необходимо исправить.
Узнаванием неправильно спаренных нуклеотидов занимается белок MutS, и, как продемонстрировали опыты исследовательской группы из Мичиганского университета, MutS вовсе не сканирует терпеливо все основания в ДНК, а скоро проскакивает их солидную часть, пока не дойдёт до того места, где происходит фактически репликация, и тут его движение очень сильно замедляется – белок начинает искать нехорошие нуклеотидные пары. Стратегия, в общем, очевидная, но экспериментальное подтверждение того, что всё как раз так и происходит, удалось взять лишь на данный момент. Опыты, обрисованные в Proceedings of the National Academy of Sciences, проводили на бактериях, но авторы работы считают, что у человека поиск неверных нуклеотидных пар идёт совершенно верно так же – совокупность мисмэтч-репарации в живом мире достаточно консервативна.
Белки, ремонтирующие ДНК, существуют не сами по себе, в клетке у них имеется множество «ассистентов», и «ассистенты» эти до сих пор известны не все. К примеру, исследователи из Копенгагенского университета опубликовали сравнительно не так давно в Nature статью, в которой говорят о том, как ремонту ДНК оказывает помощь гистон H1.
В действительности, кому тут и не быть ассистентами, если не гистонам, особым белкам-упаковщикам, неизменно связанным с клеточной ДНК и определяющим активность и пространственную структуру тех либо иных её участков. Повреждения в ней гистоны должны ощущать одними из первых. Вправду, в то время, когда в ДНК появляется большое количество разрывов, они отправляют сигнал тревоги, но как раз про тут и конкретный1 белок до последнего времени ничего не было известно.
Стоит кроме этого сообщить, кому гистоны информируют сведения о нехорошем состоянии генетической молекулы: среди их «обозревателей» – легендарный белок p53, «страж генома», как его время от времени именуют. В то время, когда в ДНК появляются повреждения, он тормозит деление и понуждает репарирующие совокупности исправить всё, что необходимо; в случае если же повреждений довольно много, он запускает программу апоптоза, клеточного суицида, дабы клетка, чего хорошего, из-за мутаций не превратилась в раковую. В то время, когда что-то не то с самим p53, велик риск развития опухоли, и вправду, масса онкологических заболеваний появляется из-за неправильной работы либо отсутствия p53.
Не в полной мере светло до тех пор пока, как сами раковые клетки ухитряются совладать с повреждениями в ДНК, но неспешно мы об выясняем всё больше: в издании Cancer Cell эксперты из Массачусетского технологического университета обрисовывают достаточно сложную схему сотрудничества нескольких клеточных белков, разрешающих опухолевым клеткам выживать в отсутствие p53. Сущность в том, что у них запускается особенная совокупность, разрешающая притормозить деление и отремонтировать такие повреждения в ДНК, с которыми кроме того опухоль не имела возможность выжить.
По большому счету, тяжело сказать о репарации ДНК, не упоминая рак – считается, что от 80 до 90 процентов онкологических болезней случается именно из-за неправильной работы репарирующих автомобилей, и работ, посвящённых связи одного с другим, публикуется довольно много. Конечно, все пробуют осознать, как возможно сделать лекарство, которое действовало бы на рак через механизмы репарации; обстановка осложняется тем, что довольно часто репарирующие совокупности играются в пользу опухоли.
Многие химиотерапевтические препараты созданы чтобы разрушать ДНК раковых клеток, а ремонтные ферменты этого именно и не допускают, так что для успешной борьбы с онкологическим заболеванием время от времени необходимо как-то подавить в злокачественных клетках ДНК-репарирующие белки и гены. Но, дабы совсем не запутать читателей огромной массой информации, о таких изучениях мы разрешим себе умолчать.
Создатель: Кирилл Стасевич
Источник: nkj.ru
Случайные записи:
Вручение Нобелевской премии Светлане Алексиевич
Похожие статьи, которые вам понравятся:
-
Нобелевскую премию по химии дали за механизмы ремонта днк
У всех живых организмов ДНК требует постоянного ремонта, и для данной цели в клетках имеется пара основных ремонтных совокупностей, помогающих…
-
Нобелевская премия по медицине и физиологии – от присуждения до награждения
Нобелевскую премию по медицине в текущем году дали за открытие лекарств против возбудителя малярии и паразитических червей, но окончательная победа над…
-
Нобелевскую премию по физике вручили за открытие осцилляций нейтрино
Нобелевскую премию поделили канадец Артур Макдональд и японец Такааки Кадзита, экспериментально доказавшие обоюдное превращение различных видов нейтрино,…
-
Нобелевскую премию по химии дали за флуоресцентную микроскопию высокого разрешения
Работы Штефана Хелля, Эрика Бетцига и Уильяма Мернера разрешили рассмотреть в клетке отдельные молекулы. Дабы разглядеть клетку и её содержимое, мы…
-


