-
Синдром альцгеймера начинается с цинка
05.10.2016
 Наука и жизнь
Наука и жизнь -
Спусковым крючком патогенного молекулярного процесса, приводящего к заболеванию Альцгеймера, помогают ионы цинка.
Нейродегенеративные заболевания, к каким относится и заболевание Альцгеймера, появляются из-за неправильного поведения некоторых нейронных белков. У любой протеиновой молекулы имеется определённая пространственная трёхмерная форма – в случае если из-за мутации верная конформация у белка не получается, он неимеетвозможности делать собственную функцию, и при таких условиях клетка отправляет его в «мусорник».
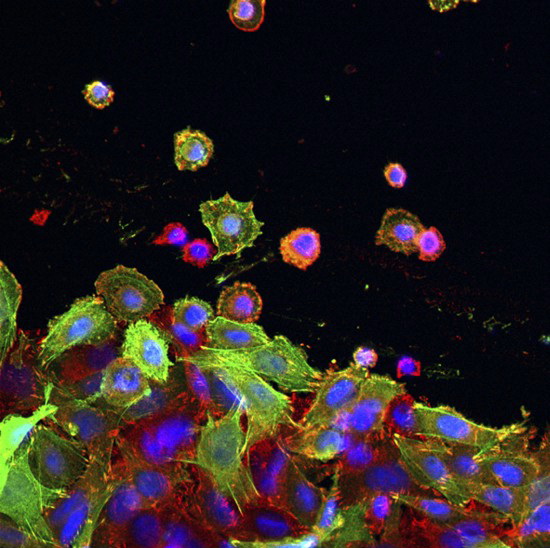
Альцгеймерические бляшки в мозге мыши. (Фото Enrique T / Flickr.com.) Структура димера мутантного амилоида, в котором две молекулы пептида связаны между собой через ион цинка (Tyr, Val, His, Glu – заглавия аминокислот с указанием их положения в пептидной молекуле, Zn – ион цинка). (Иллюстрация Польшаков В.А.)‹ ›
Но кое-какие из белков способны принимать другую конформацию, в которой они становятся не просто ненужными, а просто-таки токсичными, и наряду с этим в «мусорник» их так просто не пошлёшь.
 Токсичность же их обусловлена тем, что в другой пространственной укладке они способны образовывать большие агрегаты, каковые не хорошо воздействуют на серьёзные клеточные процессы.
Токсичность же их обусловлена тем, что в другой пространственной укладке они способны образовывать большие агрегаты, каковые не хорошо воздействуют на серьёзные клеточные процессы.При заболевания Альцгеймера такими «лицемерными» молекулами выясняются бета-амилоидные пептиды, каковые в норме помогают нейропротекторами, а при патологии – другими словами при синдроме Альцгеймера – внезапно начинают слипаться между собой, образуя массивные нерастворимые протеиновые отложения. Считается, что именно такие большие скопления белка и отравляют нервные клетки, каковые из-за них перестают проводить электрический сигнал и скоро погибают, уступая место амилоидным бляшкам.
Но, сейчас появляются эти, каковые показывают, что вред от патогенных амилоидов проявляется ещё до того, в то время, когда они начинают вываливаться в осадок, что основной токсический эффект создают большие объединения пептидов, каковые до поры до времени остаются растворимыми, вольно плавая в цитоплазме.
Как бы то ни было, на данный момент уже известно, как амилоидные пептиды слипаются, разрастаясь во всё более большие комплексы – но с чего всё начинается, до сих пор остаётся тайной. Что заставляет две самые первые свободные молекулы соединиться между собой? Разобраться в этом постарались исследователи из Университета молекулярной биологии им.
Энгельгардта и факультета фундаментальной медицины Столичного национального университета, опубликовавшие результаты собственных опытов в Scientific Reports.
По словам Владимира Польшакова, ведущего научного сотрудника факультета фундаментальной медицины МГУ и одного из соавторов статьи, ключевую роль в инициализации молекулярных процессов, с которых начинается развитие синдрома Альцгеймера, играются ионы переходных металлов, в первую очередь цинка.
Цинк занимает важное место в жизни любой клетки – к примеру, кое-какие белки, управляющие активностью генов, не смогут трудиться, в случае если их структуру не скрепить цинковыми ионами – но его сотрудничество с бета-амилоидами ни к чему хорошему, по-видимому, не приводит. Но вот как именно он с ними связывается и что именно тут происходит, до сих пор остаётся неясным.
Дабы определить это, необходимо изучить структуру молекулярных комплексов – фрагментов амилоидных пептидов, взаимодействующих с ионом металла. Опыты проводили как с обычным бета-амилоидным пептидом, так и с мутантным, в котором одна из аминокислот была заменена на другую, и с изомеризованным пептидом, не отличавшимся по аминокислотному составу от обычного, но в котором в одной из аминокислот атомы размешались в противном случае (другими словами она была изомером такой же аминокислоты, что пребывала в том же положении в обычном бета-амилоиде).
Про пептид-изомер было как мы знаем, что он появляется спонтанно, без участия ферментов, что его накопление улучшается с возрастом, и что у мышей он приводит к стремительному формированию альцгеймерических бляшек в мозге – в присутствии же цинка такие пептиды слипались между собой чуть ли не мгновенно.
Нарастание амилоидов во всех трёх случаях – с обычным пептидом, с изомеризованным и с мутантным – имеет собственные особенности. Но, как продемонстрировал анализ молекулярных комплексов, совершённый посредством ядерно-ряда и магнитного резонанса вторых способов, начальные стадии в каждой случае полностью однообразны: во всех трёх вариантах всё начинается с того, что ион цинка скрепляет два пептида.
Скорость предстоящей агрегации зависит от того, какой конкретный вид амилоидных пептидов участвует в ходе, как он склонен к слипанию, но, как бы ни повернулись предстоящие события, в начальной точке постоянно будет димер с цинком в качестве межмолекулярной скрепки.
Предлагаемый «цинковый» механизм превращения хороших амилоидов в нехорошие согласуется не только с результатами опытов самих авторов работы, но и с результатами вторых лабораторий. И, не смотря на то, что на вышеописанное сотрудничество, разумеется, смогут воздействовать и другие молекулярные, клеточные и физиологические факторы, новые эти в полной мере возможно применять для лекарств, каковые, предотвращая слипание пептидов с цинком, защищали бы мозг от синдрома Альцгеймера.
По данным пресс-службы МГУ имени М.В. Ломоносова.
Создатель: Кирилл Стасевич
Источник: nkj.ru
Случайные записи:
О самом главном: Болезнь Альцгеймера, очищение крови
Похожие статьи, которые вам понравятся:
-
Лекарственные антитела тормозят болезнь альцгеймера
Человеческие антитела против патогенного белка, вызывающего заболевание Альцгеймера, уничтожают страшные протеиновые отложения в мозге больных….
-
Как свет помогает мозгу бороться с болезнью альцгеймера
Световые импульсы определённой частоты уменьшают уровень патогенных белков, запускающих нейродегенеративные процессы. Заболевание Альцгеймера, как и…
-
Как остановить болезнь альцгеймера
Заболевание Альцгеймера страшна не столько протеиновыми отложениями в мозге, сколько маленькими молекулярными комплексами, каковые именно и отравляют…
-
Преждевременное старение начинается из-за «беспорядка» в днк
Чем больше хромосомной ДНК находится в распакованном, активном виде, тем раньше и стремительнее клетка начинает стареть. Все люди стареют по-различному,…
-