-
Альцгеймерический белок защищает от инфекций
01.06.2012
 Наука и жизнь
Наука и жизнь -
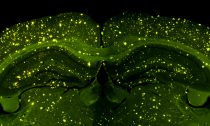
Противомикробные особенности альцгеймерического бета-амилоидного пептида удостоверились в надежности на животных.
Как мы знаем, что заболевание Альцгеймера и другие подобные нейродегенеративные болезни начинаются по причине того, что в нейронах мозга скапливаются протеиновые отложения, в следствии которых нервные клетки начинают не хорошо трудиться и в итоге гибнут.
Альцгеймерические бляшки в мозге мыши. (Фото Enrique T / Flickr.com.) Нити их молекул альцгеймерического бета-амилоида, опутывающие дрожжевые клетки. (Фото D.K.V. Kumar et al., Science Translational Medicine.)‹ ›
Таких страшных белков существует множество, и при синдрома Альцгеймера в большинстве случаев говорят про бета-амилоид (что в большинстве случаев из-за маленького размера – всего около 40 аминокислот – именуют пептидом). Он образуется при расщеплении более большой молекулы, так именуемого предшественника бета-амилоида.
Конечно, сходу появляется вопрос, для чего клетке необходимы оба эти белка – так как было бы очень необычно, если бы их единственным назначением было вредить нейронам.
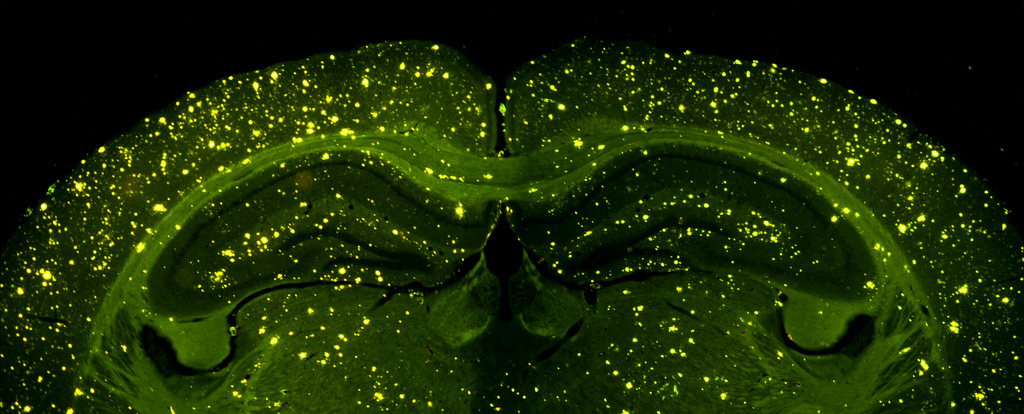 Для предшественника бета-амилоида, сидящего в клеточной мембране и талантливого взаимодействовать с какими-то вторыми молекулами, нужные функции нашли, но вот сам бета-амилоид, из которого именно и получаются протеиновые свалки, продолжительное время вычисляли легко метаболическим мусором. В здоровом мозге его мало, так что логично было бы высказать предположение, что заболевание начинается с поломки мусороуборочной автомобили – бета-амилоид накапливается и начинает портить клетке жизнь.
Для предшественника бета-амилоида, сидящего в клеточной мембране и талантливого взаимодействовать с какими-то вторыми молекулами, нужные функции нашли, но вот сам бета-амилоид, из которого именно и получаются протеиновые свалки, продолжительное время вычисляли легко метаболическим мусором. В здоровом мозге его мало, так что логично было бы высказать предположение, что заболевание начинается с поломки мусороуборочной автомобили – бета-амилоид накапливается и начинает портить клетке жизнь.Но неспешно начали появляться информацию о том, что и бета-амилоид возможно нужен. Так, пара лет назад Рудольф Тэнци (Rudolph Tanzi) и его коллеги из Общеклинической больницы и Гарвардского университета штата Массачусетс поняли, что бета-амилоидные пептиды, как синтетические, так и натуральные, подавляют рост последовательности бактерий и опасных дрожжей Candida albicans, талантливых при ослабленном иммунитете позвать кандидоз. Эффект от бета-амилоида был такой же, как от антимикробного пептида LL-37, содержащегося в макрофагах клетках и иммунных лейкоцитах.
В новой статье, размещённой в Science Translational Medicine, те же исследователи пишут о том, как альцгеймерический белок трудится в живых организмах. Его антимикробные свойства испытывали, во-первых, на мышах, во-вторых, на червях нематодах, и, в-третьих, на культуре клеток. Мышей модифицировали так, дабы у них в мозге синтезировалось большое количество человеческого бета-амилоида, но дабы при том не образовывалось патологических отложений – известных амилоидных бляшек.
После этого в мозг животным запускали бактерию Salmonella typhimurium.
Оказалось, что у мышей с повышенным уровнем бета-амилоида шанс выжить по окончании заражения увеличивался. Трудился пептид так: спустя ночь по окончании появления начала заразы у животных оказались пресловутые амилоидные бляшки, каковые заключали в себе бактериальные клетки. Сами по себе такие отложения, как мы только что сообщили, у мышей не образовывались, и по большому счету, как полагают, при синдрома Альцгеймера они формируются годами, и только позже заболевание делается явной и заметно ускоряется.
При же микробного вторжения бляшки, как видим, появляются скоро, обезвреживая патогенные клетки.
Червей нематод передавали не бактерией, а дрожжами, и тут была та же картина: черви, каковые по окончании биотехнологических манипуляций купили свойство синтезировать человеческий бета-амилоид, жили с дрожжевой заразой на 3–4 дня продолжительнее, что для короткоживущих нематод в действительности много. Наконец, опыты с клеточными культурами, каковые сами синтезировали бета-амилоид, продемонстрировали, что альцгеймерический пептид не даёт грибку прикрепиться к клеткам, формируя протеиновые нити и удерживая в них дрожжи. Такие же нити оказались и в желудке червей, защищая их от заразы.
В действительности, похожим образом трудятся и кое-какие простые антимикробные пептиды, применяемые иммунной совокупностью – они как бы заключают патоген в пептидную «колонию», дабы позже убить. Учитывая, что бета-амилоид именно и известен собственной свойством вырабатывать долгие тяжи (каковые позже при заболевания складываются в большие отложения), от него в полной мере возможно было ожидать такой же реакции на бактерий либо на какую другую заразу.
В параллель новым итогам возможно отыскать в памяти о том, что у прионных белков сейчас также стали находить нужные функции. Прионы и белки синдрома Альцгеймера, синдрома Паркинсона и пр. во многом похожи – прионы так же портят нервную совокупность, заполняя нейроны огромными весами слипшихся протеиновых молекул. Но оказалось, что именно эта их свойство слипаться оказывает помощь дрожжам выживать в экстремальных условиях, а у дрозофил прионные комплексы поддерживают долгосрочную память.
И однако, каким бы нужным бета-амилоид ни был, на протяжении заболевания с ним всё равняется необходимо что-то делать. Лекарств от нейродегенеративных расстройств до тех пор пока что нет, не смотря на то, что многие лаборатории трудятся над тем, дабы отыскать средство, которое избавляло бы нейроны от негативных протеиновых отложений, удаляло бы излишек бета-амилоида либо хотя бы мешало бы его слипанию.
В свете последних результатов, разумеется, к такому лекарству добавляется дополнительное требование: оно не должно всецело удалять бета-амилоидный пептид из клеток и не должно всецело подавлять его слипание – в другом случае имеется возможность, что пострадает отечественная антимикробная защита.
Создатель: Кирилл Стасевич
Источник: nkj.ru
Случайные записи:
- Масштаб возвращения homo sapiens в африку переоценили
- Как в средневековой англии предотвращали «восстание мертвецов»
Российско-белорусская команда генетиков выделила человеческий белок из козьего молока
Похожие статьи, которые вам понравятся:
-
Белок болезни хантингтона нужен для правильного развития мозга
Без обычного белка хантингтина синапсы в развивающемся мозге сперва быстро формируются, а позже столь же быстро разрушаются. Заболевание Хантингтона, как…
-
В теле человека обнаружен белок, защищающий сердце
Исследователи из Английского университета Королевы Марии (Queen Mary, University of London)и их коллеги из Университета Суррея (University of…
-
Белок, что оказывает помощь иммунитету отличать «собственных» от «чужих», с возрастом подавляет появление новых клеток в мозге, ухудшая когнитивные…
-
Стрессовый белок поможет в борьбе с сепсисом
Капсульные посылки с одним из белков теплового шока оказывают помощь иммунным клеткам выстоять в борьбе с бактериальными ядами. Сепсис, либо…


