-
Crispr позволила «исправить» смертельно опасные мутации во взрослом организме
06.07.2010
 Hi-tech
Hi-tech -
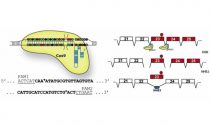
Сходу три группы исследователей независимо друг от друга сказали об удачах в лечении генетических болезней посредством способа редактирования генома CRISPR. Точечно «исправляя» гены, мутации в которых ведут к тяжелым нарушениям развития мышечной ткани, авторы частично вернули ее функциональность у взрослых мышей, страдавших от миодистрофии. Результаты работ публикует издание Science, коротко о нем возможно прочесть в пресс-релизе американского Университета Дьюка.
Миодистрофия Дюшенна (DMD) — генетическое заболевание, которое начинается приблизительно у одного из 5000 детей. Вызывается оно делецией одного либо нескольких экзонов в гене, кодирующем белок дистрофин. Это ведет к сдвигу рамки считывания в гене и образованию всецело нефункционального белка, что в норме нужен для поддержания целостности мембран мышечных клеток. Ген расположен на Х-хромосоме, исходя из этого у мальчиков, имеющих только одну его копию, DMD начинается чаще.
К 10-летнему возрасту больные, в большинстве случаев, уже прикованы к коляске, и редко кто их них живёт продолжительнее 20–30 лет.
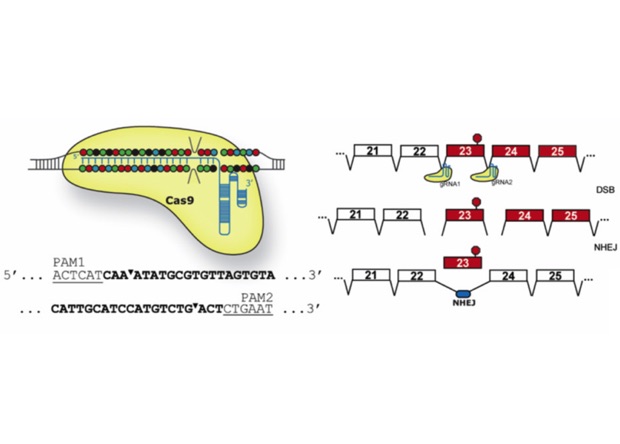
Cas9-нуклеаза разрезает ДНК в помеченных посредством РНК участках на границе экзона 23, по окончании чего он удаляется, а разрыв сшивается.
 © Christopher E. Nelson et al., 2015
© Christopher E. Nelson et al., 2015Только пара месяцев назад группе доктора наук Университета Дьюка Чарльза Гершбаха (Charles Gersbach) удалось удачно скорректировать страшную мутацию in vitro, в линии «больных» клеток. Сейчас же ученые применяли CRISPR-технологии для «исправления» нарушений в целом взрослом организме. Дабы вернуть рамку считывания гена в необходимое положение, авторы удалили дополнительно один из его экзонов (23).
Нужные белки были доставлены в мышечные клетки посредством модифицированного аденоассоциированного вируса AAV8. Делеция экзона 23 удачно прошла приблизительно в 2 процентах клеток и разрешила лабораторным животным синтезировать функциональный дистрофин числом приблизительно 8 процентов от нормы (наряду с этим уже 4 процента достаточно для снятия самые опасных признаков DMD).
Параллельно этому проблемой занималась и несколько доктора наук Мичиганского университета Дуншеня Дуаня (Dongsheng Duan). Для начала авторы подтвердили эффективность CRISPR-совокупности на сперматозоидах и яйцеклетках мышей, имевших связанные с DMD мутации – и очень удачно: 80 процентов мышат, показавшихся из отредактированных половых клеток, не имели самые тяжёлых форм DMD. После этого способ был опробован на больных животных пара дней по окончании рождения.
Для таргетированной доставки CRISPR-совокупности в мышечные клетки взрослой мыши авторы кроме этого применяли аденоассоциированный вирус (AAV9), задачей кроме этого была дополнительная делеция экзона 23. Контролируя эффективность доставки, авторы делали подопытным животным инъекции или конкретно в мускулы, или в глазное дно, продемонстрировав, что лучше способ действует при прямой инъекции в мускулы.
Третья работа совершена командой одного из пионеров CRISPR-разработок Фэн Чзаня (Feng Zhang). Несколько применила все тот же подход с применением вируса ААV9 и целевой делецией экзона 23, взяв столь же обнадеживающие результаты. Но параллельно этому ученые попытались отследить воздействие введенной в организм CRISPR-совокупности на клетки, далекие от места инъекции.
Посредством флуоресцентных маркеров они продемонстрировали, что у некоторых из них экспрессия обычного дистрофина восстанавливалась – и делают вывод о перспективности совокупности AAV-CRISPR для лечения генетических болезней у взрослого организма in vivo.
Создатель: Роман Фишман
Случайные записи:
- Кофе по-итальянски снизил риск рака простаты
- Технология переработки (измельчения) неорганических материалов до наноразмеров
ZEITGEIST: MOVING FORWARD | OFFICIAL RELEASE | 2011
Похожие статьи, которые вам понравятся:
-
Для системы crispr нашли аварийный выключатель
Американские ученые нашли метод выключать совокупность редактирования генома CRISPR/Cas9 посредством белков-антагонистов, найденных в геноме…
-
Crispr идентифицировал возможные гены, «пропускающие» вич
Неизвестно, разрешит ли инструмент редактирования генома CRISPR/Cas9 создавать супергеров, но в чем он вправду оптимален, так это в стремительном…
-
Создан первый организм с искусственным геномом
Ученым в первый раз удалось создать организм с синтетическим геномом. Статья с описанием работы размещена в издании Science. Кратко опыт обрисовывает…
-
Молекулы в сердце регулируют энергетический гомеостаз всего организма
Как направляться из результатов изучения, совершённого учеными Юго-западного медицинского центра Техасского университета (UT Southwestern Medical…


