-
Химики впервые собрали стабильный пятиугольник из азота
20.12.2013
 Hi-tech
Hi-tech -
Химики из Нанкинского и Ляонинского научно-технологических университетов в первый раз синтезировали стабильную соль незамещенного пентазола —химического соединения, в котором пять атомов азота объединены в пятиугольный цикл. Подобные пентазолу соединения занимательны огромным числом энергии, которое они запасают — на их базе возможно создано горючее для космических судов, кроме этого они увлекательны с позиций армейских применений. Изучение размещено в издании Science.
В химии известно мало частиц, всецело состоящих лишь из атомов азота, но наряду с этим устойчивых при простых условиях. Это нейтральный азот (N2) и заряженные частицы: азиды (N3-) и пентазиний (N5+). Интерес к подобным соединениям позван тем, что в соответствии с теоретическим расчетам, их производные могут быть хорошими взрывчатыми либо легко высокоэнергетическими соединениями.
Исходя из этого химики пробуют увеличить перечень этих частиц, синтезируя и стабилизируя новые азотистые кластеры.
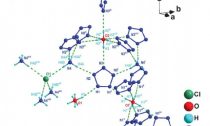
Строение молекулярного комплекса пентазолата аммония.
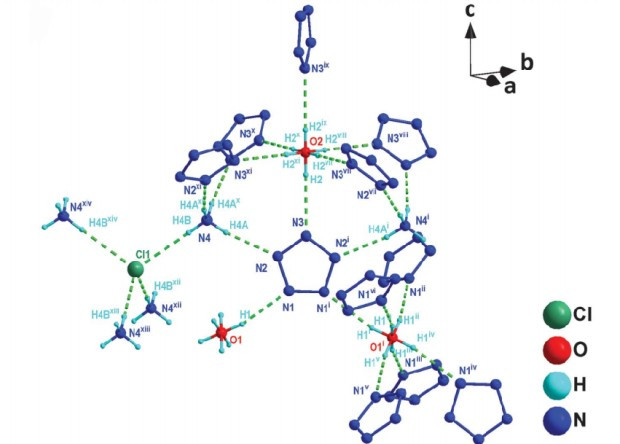 Chong Zhang et al. / Science, 2017
Chong Zhang et al. / Science, 2017Один из объектов этого поиска — пентазолы, пятиатомные циклические молекулы, складывающиеся из атомов азота иодного атома водорода (HN5). Практически во всех известных стабильных производных пентазолов атом водорода замещенна бензольное кольцо (либо другие ароматические ядра). Существовали предположения, что соль, грамотный анионом незамещенного пентазола и N5+ можетоказаться термодинамически устойчивой.
При таких условиях у азота показалась бы первая ионная аллотропная модификация состава N10.
Но продолжительное время взять незамещенный пентазол не получалось. Только в 2002 году частица наблюдаласьв газовой фазе. Для синтеза исследователи селективно разрывали связь между ентазолом и стабилизирующим его бензольным ядром в условиях электроспрей весов-спектрометрии.
Взять же жёсткие пентазолы не получалось до сих пор.
Авторы новой работы применяли для синтеза солипентазолат-аниона подобный подход. Химики синтезировали синтезировали замещенный фенилпентазол и применяли для разрыва связи между двумя циклами реакцию окисления. В роли окислителя ученые выбрали мета-хлорпербензойную кислоту — это вещество содержит в собственной структуре пероксидный фрагмент.
В следствии химики кристаллизовали устойчивую при комнатной температуре соль строения (N5)6(H3O)3(NH4)4Cl.
Ученые отмечают, что нежданно высокая устойчивость (соединение начинает разлагаться только при нагреве до 117 градусов Цельсия) связана с кристаллической структурой соли. В ней пентазольный фрагмент соединен водородными связями с катионами аммония и гидроксония. При удалении хлорид-аниона (равно как и при удалении аммония) происходит разложение полиазотистого ядра.
Примечательно, что два месяца назад, в декабре 2016 года, вышла вторая статья, посвященная синтезу пентазолата цезия. Но это вещество выяснилось стабильным только при больших давлениях. В ней пентазолаты были синтезированы прямой реакцией между азидом цезия (CsN3) и жидким аммиаком при давлении 600 тысяч воздухов.
Пентазолаты относятся к второму редкому классу веществ — неорганических ароматических ионов. Эти вещества владеют ароматичностью, присущей, к примеру, бензолу. Его изоэлектронным аналогом есть циклопентадиенил-анион.
Ранее мы информировали синтезе вторых неорганических ароматических соединений: дифосфатриазолат-аналога и аниона бензола из мышьяка и кремния.
Создатель: Владимир Королёв
Случайные записи:
- Награждение победителей конкурса нир и семинар с участием компаний — партнеров vi всероссийской интернет — олимпиады по нанотехнологиям
- В мгу пройдёт молодёжный научный форум «ломоносов-2010»
Химики \
Похожие статьи, которые вам понравятся:
-
Химики придумали новую химическую реакцию для фармацевтики
Химики создали новую химическую реакцию для синтеза веществ, обширно использующихся в сельском хозяйстве и фармацевтической промышленности. Новая…
-
Неуглеродные формы жизни: кремний или азот?
Существование иных форм судьбы, принципиально отличающихся от отечественной земной наличием, количеством и расположением лап, глаз, зубов, когтей, других…
-
Ученым впервые удалось измерить изменения энергии атомов во время химической реакции
В первый раз в истории современной науки ученым удалось сделать то, что ранее считалось неосуществимым – измерить энергию атомов молекулы на протяжении…
-
Гонка за спортивными результатами привела и в «школьных» подклассах автомоделизма к профессионализации техники. На смену прекрасно привычным МК-17 пришли…